1. 실험 제목 : 카페인 추출
2. 실험 날짜 :
3. 실험 목적 :
화합물의 분리, 정제에 사용되는 추출법을 이용해서 홍차잎으로부터 카페인을 추출한다
4. 실험 이론 :
화합물을 분리하는 과정은 혼합되어 있는 화합물의 특성에 따라서 매우 다양한데 그중 하나인 추출 (extraction)은 용매에 따라서 서로 다른 화합물의 용해도가 큰 차이를 보이는 경우에 사용되는 분리방법이다. 고체에 포함되어 있는 화합물을 녹여내는 경우는 물론이고, 수용액과 유기 용매에 녹는 특성이 다른 점을 이용한 추출 방법도 널리 사용된다.
물에 잘 녹지 않는 유기용질은 유기 용질을 잘 녹이면서도 물과 섞이지 않는 유기 용매를 사용하여 유기 용매 층으로 추출할 수 있다. 벤젠이나 헥세인처럼 물보다 밀도가 작은 유기용매는 물 보다 위에 층을 이루게 되고, 메틸렌 클로라이드나 클로로폼과 같이 밀도가 큰 유기용매는 물 보다 아래에 층을 이루게 된다.
물과 유기용매가 담긴 분별 깔떼기를 잘 흔들어주면 용질이 두 용매층 사이에서 평형을 이루게 되고, 이 때 두 층에서의 용질의 농도비를 분배계수 (distribution coefficient)라고 부른다

분배계수가 1보다 큰 경우에는 같은 부피의 용매 A와 B를 사용할 떄는 처음에 B에 녹아있던 용질의 절반 이상이 용매 A로 옮겨가게 되고, 용매 A를 분리해서 적당한 방법으로 용매를 제거하면 순수한 용질을 얻을 수 있게 된다.
이런 추출방법을 여러차례 반복해서 적용하면 용질을 상당히 순수한 형태로 얻을 수 있다.
이 실험에서는 홍차 잎에 포함되어 있는 카페인을 뜨거운 물로 추출해 낸 다음에 물과 섞이지 않는 메틸렌 클로라이드 용매를 사용해서 물에 녹아있는 카페인을 순수한 상태로 분리한다.
카페인이 수용액에서 유기 용매 층으로 쉽게 빠져나가도록 하기 위해서 분별깔때기에 두 용액을 함께 넣고 흔들어주어야 한다. 분별깔때기를 너무 세게 흔들면 섞이지 않는 용매의 작은 방울로 된 에멀션 (emulsion)이 만들어져서 분리 효과가 떨어질 수 있다.
수용액층에 NaCl과 같은 염을 넣어주면 수용액에 녹아있는 유기물이 유기용매층으로 더 많이 옮겨가는 경우가 있는데 이런 현상을 염석효과 (salting-out effect)라 한다.
홍차티백에서의 카페인 추출은 고체-액체 추출이고 용액 속 카페인 추출은 액체-액체 추출이다.

*추출 : 용매에 따른 용질의 용해도 차이가클 경우에 분리 방법. 고체에 포함된 물질의 분리에 주로 사용
*에멀션 : 액체가 다른 액체에 클로이드 상태로 퍼져있는 상태의 물질
*염석효과 : 친수성 콜로이드 상태의 용액에 전해질을 가하여 서로 엉키게 만들어 추출하는 작용
*분배계수 : 서로 섞이지 않는 두 액체 A, B가 분리되어 접해있을 경우 두 용매에 모두 녹을 수 있는 용질을 넣고, 용질이 두 용매층 사이에서 평형을 이룰 때의 용질의 농도 비
K = 용매 A에서의 용해도 / 용매 B에서의 용해도
*카페인의 분자구조
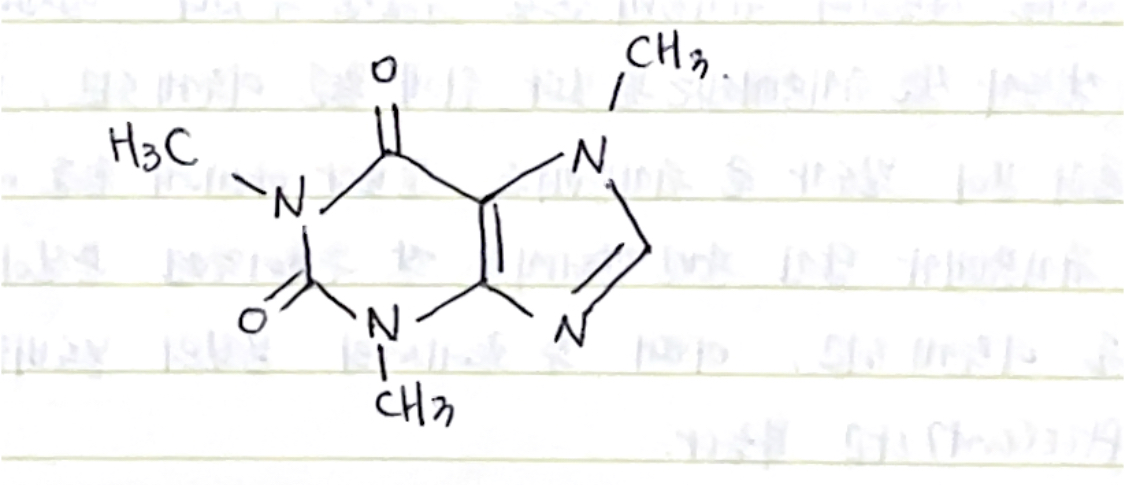
5. 시약 및 기구 :
100ml 비커 두 개, 눈금실린더, 가열기, 뷰흐너 깔때기, 감압플라스크, 감압기, 약숟가락, CaCO3 0.4g, 포화 NaCl 용액, Na2SO4 2~3숟가락
6. 실험 방법 :
1) 100ml 비커 두개에 각각 60ml와 30ml의 물을 넣고 50~60'c 로 가열.
2) 60ml의 물이 담긴 비커에 홍차 (티백포장6개)와 CaCO3 0.4g을 넣고 20-30분간 가열한다.
3) 뜨거운 물은 조금 식힌 다음에 홍차 봉지를 꺼내서 손으로 눌러 짜고 30ml의 물이 담긴 비커에 넣어 다시 한번 가열하고 봉지를 눌러 싼다.
4) 뷰흐너 깔때기에 거름종이를 올려좋고 3)에서 준비한 용액을 감압기를 사용해서 거른다.
분별깔때기의 용량이 크지 않으므로 작은 양의 물을 사용해서 비커에 남아있는 홍차 용액을 씻어서 뷰흐너 깔때기에 함께 넣는다.
5) 거른 용액을 2)에서 얻응용액과 함께 분별 깔때기에 넣는다.
5) 메틸렌 클로라이드 6ml와 포화 NaCl 용액 3ml를 함께 넣고 분별 깔때기의 마개를 막은 후 10분 이상 가볍게 흔들어준다. 너무 세게 흔들면 에멀전이 만들어지기 때문에 조심해야 한다. 에멀션이 생기면 분별깔때기를 돌려가면서 가볍게 흔들어주고, 그래도 없어지지 않으면 약숟가락을 사용해서 에멀션 근처를 조심해서 저어준다.
7) 분별 깔떄기를 스탠드에 세워두고 잠시 기다린 후에 아래쪽의 메틸렌 클로라이드 용액을 비커에 받아낸다.
8) 위쪽에 남은 수용액 층에 다시 메틸렌 클로라이드 6ml와 포화 NaCl 용액 3ml를 넣고 추출하는 과정을 세 번 정도 더 반복하고, 메틸렌 클로라이드 용액을 함께 모은다.
9) 메틸렌 클로라이드 용액에 건조제인 NaSO4를 2-3숟가락 넣고 잘 흔들어준다.
10) 뷰흐너 깔때기를 사용해서 건조제를 걸러낸다.
11) 감압기를 이용하여 메틸렌 클로라이드를 증발시킨다. 이 때 40'c 정도의 뜨거운 물을 준비해서 중탕을 시켜주면 증발속도를 빠르게 할 수 있다.
7. 참고문헌 :
8. 실험 결과 :
CaCO3를 사용하는 이유?
홍차 티백에는 카페인과 유기산이 들어있다. 그런데 유기산이 물에 먼저 녹게 되면 카페인은 녹지 못하게 되므로 카페인이 유기용매로 이동하게 된다. 따라서 염기인 CaCO3를 넣고 가열하면 서로 반응하여 침전된다.
NaCl을 넣는 이유?
물층에 있는 카페인을 더 많이 메틸렌 클로라이드 층으로 옮기기 위해서 포화 NaCl 수용액을 넣는다. NaCl을 넣게 되면 물은 카페인보다 이온인 NaCl을 더 잘 녹이고 카페인을 덜 녹이게 되어 메틸렌 클로라이드 층에 카페인이 더 녹게 된다. 이 현상을 염석효과라고 한다.
NaSO4를 넣는 이유?
분리한 메틸렌 클로라이드에는 카페인이 녹아있는데 소량의 물이 남아있을 수 있다. 이 물로 인하여 순수한 카페인을 얻을 수 없으므로 NaSO4를 넣는데 물은 NaSO4의 수화물 형태로 제거된다.
제 블로그를 찾아주셔서 감사합니다!
도움이 되셨다면 댓글 혹은 공감 부탁드립니다.✒️
'실험노트 > 일반화학 실험' 카테고리의 다른 글
| [실험노트] 일반화학 실험 8. 액체 자성물질 합성 (1) | 2024.06.04 |
|---|---|
| [실험노트] 일반화학 실험 7. 비누화 반응 (2) | 2023.11.17 |
| [실험노트] 일반화학 실험 5. PDMS 를 이용한 미세접촉 인쇄 (0) | 2023.04.10 |
| [실험노트] 일반화학 실험 4. PDMS 탱탱공 만들기 (0) | 2022.09.02 |
| [실험노트] 일반화학 실험 3. 크로마토그래피 (1) | 2022.08.31 |




댓글