1. 실험 제목 : 화학반응속도 (시계 반응)
2. 실험 날짜 :
3. 실험 목표 : 시계 반응을 이용해서 반응 속도의 차이가 큰 반응 단계가 연속적으로 일어나는 화학반응의 특성을 알아본다.
4. 실험 이론 :
- 반응속도 (reaction rate)

- 반응 차수
위 식의 m, n을 말한다. m+n = 전체 반응 차수이다.
- 시계 반응 (clock reaction)
시계 반응은 마치 중화점을 찾는 반응처럼 반응 도중에 갑자기 색이 변해 그것이 마치 자명종처럼 보인다고 해서 붙여진 이름이다. 화학반응에는 단순한 과정을 거쳐서 일어나는 것도 있지만 여러 가지 반응들이 몇 단계에 걸쳐서 일어나는 것도 있는데 이 원리를 이용한 것이다. 지시약을 같이 넣어두었다가 첫 번째 반응에서 생성되었던 물질과 두 번째 반응에서 반응하는 물질이 모두 소모되면 첫 번쨰 반응에서 생성되었던 물질이 남게 되어 그것이 지시약의 색을 갑자기 변화시킨다. 그러나 그 전에는 아무런 변화도 느끼지 못한다. 이처럼 갑자기 변하는 반응이 시계와 같다고 해서 시계 반응이라고 하며 이것으로 반응이 종결되었음을 알 수 있다.
반응 속도에 영향을 주는 요인
1) 반응물의 종류
이온 간의 반응은 빠르고, 원자 간 결합이 끊어져 재배열을 일으키는 반응은 느리다. 결합력이 강하고 결합이 많을수록 느림
2) 농도
농도 증가 -> 단위 부피 속 입자수 증가 -> 충돌 횟수 증가 -> 반응속도 빠름
표면적이 클수록 반응속도 빠르고, 농도 클수록 부분 압력이 커져서 반응속도 빨라짐
3) 온도
온도가↑ -> 분자 평균 운동 E 증가 -> 충돌 횟수↑ -> 반응속도↑
4) 촉매
반응속도 변화시키고, 자신은 변하지 않는 물질
정촉매: 활성화 E 작게 -> 반응속도↑
부촉매: 활성화E 크게 -> 반응속도↑
우리 실험에서
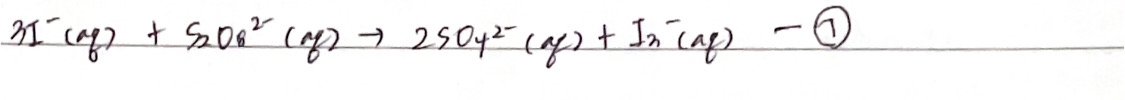
위 반응의 반응속도는 다음과 같이 나타낼 수 있으며 매우 느리게 진행되는 반응이다.

I3- 이온은 용액에 S2O3- 이온이 들어있다면 다음과 같이 반응하여 없어지고 이 반응은 매우 빠르게 진행된다.

만일 용액 중에 들어이는 S2O3(2-)의 양이 제한적이라면 위 반응에 의하여 S2O3(2-)가 모두 소진되면 I3-이온은 더 이상 위 반응을 하지 못하게 되고 용액 속에 들어있는 녹말과 결합하여 진한 청색의 착화합물 (complex)을 형성하게 된다. 이때 녹말은 지시약으로서의 역할을 한다. 즉, 반응이 시작되고 일정한 시간이 지나면 용액은 청색을 내게 되며 이와 같은 반응을 시계 반응이라 한다. 일정 시간 후 자명종이 울리는 것과 비슷하다고 할 수 있다.
이때 반응이 시작하여 청색이 나타날 때까지 걸리는 시간은 S2O3(2-)의 양과 ㄱ)반응의 반응속도에 의하여 결정된다. 반응속도는 시간의 역수이고 따라서 I-와 S2O3(2-)의 농도를 바꾸어가며 반응속도 (청색이 나타날 때까지 걸리는 시간의 역수) 를 측정함으로서 ㄱ) 반응에 대하여 식 ㄴ)의 반응차수 m, n을 구할 수 있고 반응속도상수 K도 구할 수 있다.
이 실험은 이온들의 반응이다. 이온들의 반응은 용액에 존재하는 모든 이온의 농도에 따라 달라질 수 있다. 따라서 I-와 S2O3(2-)의 농도를 바꾸더라도 전체 이온의 농도는 일정하게 유지되어야 한다. 이를 위하여 KCl이나 (NH4)2SO4를 사용한다.
-착화합물 (complex)
배위 화합물이라고 하며 비어있는 오비탈이 많은 중심 금속이온에 리간드의 고립 전자쌍이 배위 결합을 통해 형성된다. 중심 금속은 주로 원자번호 21번~30번의 전이금속이다.
5. 실험 방법
적어도 3배 이상의 다른 농도에서 실험을 하여야 m, n, k 값을 구할 수 있다.

1) 위에 표시된 용액을 정확히 피펫으로 측정하여 각각 100ml 플라스크와 50ml 플라스크에 넣는다. (단 KCl과 (NH4)2SO4 는 이온 농도를 맞추기 위한 것이므로 메스실린더로 측정해도 된다.)
2) 100ml 플라스크에 0.005M NaS2O3 용액 5.00ml(정확히)를 넣고 녹말 지시약 몇 방울을 떨어뜨린다.
3) 플라스크에 온도계를 넣고 stop watch를 준비한다(초단위)
4) 50ml 플라스크에 있는 내용물을 모도 재빨리 100ml 플라스크로 부어 반응을 사직시킴과 동시에 시간 측정을 시작한다.
5) 반응이 잘 진행되도록 흔들어 주면서 용액이 청색으로 바뀌는 순간까지의 시간을 기록한다. 또한 이때의 온도를 함께 기록한다.
6) 표에 나와있는 다른 농도에 대해서도 같은 실험을 반복한다. (최소 3가지 이상) 이때 반응시키기 전 용액을 충분히 세척하고 습기를 최대한 제거하는 것이 좋다.
6. 실험기구 및 시약
KI, KCl, (NH4)2SO8, (NH4)2SO4, 피펫, 플라스크 100ml, 50ml, 녹말 지시약, Na3S3O4, 온도계, stop watch
7. 참고문헌
www.wikipedia.org

제 블로그를 찾아주셔서 감사합니다!
도움이 되셨다면 댓글과 공감 부탁드립니다.✒️
'실험노트 > 일반화학 실험2' 카테고리의 다른 글
| [실험노트] 일반화학2 실험 9. 은 나노 입자의 합성 실험보고서 (1) | 2022.11.16 |
|---|---|
| [실험노트] 일반화학2 실험 7. 평형상수와 용해도 곱 (1) | 2022.11.10 |
| [실험노트] 일반화학2 실험 6. 양이온 음이온의 정성분석 실험보고서 (0) | 2022.11.06 |
| [실험노트] 일반화학2 실험 5. 물의 경도 측정 실험보고서 (0) | 2022.09.28 |
| [실험노트] 일반화학2 실험 4. OLED 합성 및 제작 실험보고서 (0) | 2022.09.14 |




댓글