1. 실험 제목 : 물의 경도 측정
2. 실험 날짜 :
3. 실험 목적 :
4. 실험 원리 :
일상적으로 우리가 접하는 물에는 소량의 금속 이온이 포함되어 있다. 주로 Ca(2+) 이온과 Mg(2+) 이온이 포함되어 있으며 이들 이온이 포함되어 있는 정도에 따라 물의 경도(hardness)를 나타내고 Ca(2+)와 Mg(2+)에 의한 물의 경도는 mg/L CaCO2(ppm)으로 표시된다. 따라서 물의 경도 측정을 위하여 Ca(2+)와 Mg(2+)의 양을 측정할 필요가 있으며 일반적으로 Ca(2+)와 Mg(2+)의 총합을 측정하게 된다.
이 실험에서는 EriochromeBlack(EBT) 지시약을 사용하여 EDTA로 적정하고 이를 측정한다. Mg(2+)이 없는 시료 적정 시에는 뚜렷한 종말점을 얻기에 앞서 적정 플라스크에 Mg-EDTA를 넣는다. Ca(2+)은 EBT 지시약과 반응해서 두렷한 종말점이 나타나기에 충분한 칼레이트를 만들지 못하기 때문이다.
반응식

적정의 종말점에는 다음과 같은 변색이 일어난다.
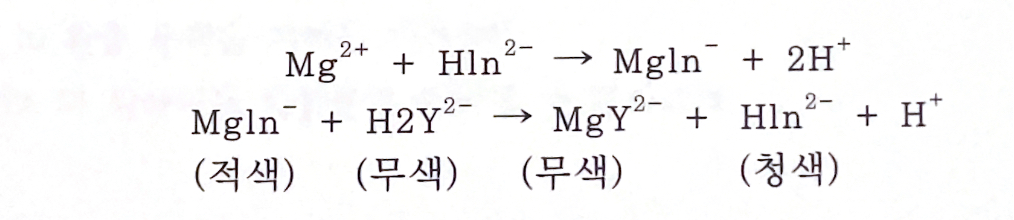
여기서 지시약은 In이고, 적정액 EDTA는 Y로 나타내었다.
*추가조사
EDTA란?
EDTA (ethylene-diamine-tetraacetic acid)(C10H16N2O8) 는 특정 금속 이온 (칼슘, 마그네슘과 같은 2가의 금속이온)과 결합하여 카이랄성을 가진 칼레이트 화합물을 만든다.

칼레이트 화합물이란?
칼레이트는 한 개의 리간드가 금속 이온과 두 자리 이상에서 배위결합을 하여 생긴 착이온을 뜻한다.
완충용액이란?
산이나 연기를 넣어도 일정한 양 까지는 pH 변화가 거의 없는 용액을 말한다. 완충용액은 약산과 그 짝염기를 넣는 방법으로 제조하는데 완충 용량 (pH 변화가 거의 없는 양) 이 가장 크려면 약산과 짝염기의 몰수가 같아야 한다.
완충용액의 원리는 르샤틀리에 원리에 의해 설명된다.

(폼산과 그 짝염기로 만들어진 완충용액의 반응)
이때, 용액에 산성 용액을 첨가할 경우 생성루에 해당하는 수소 이온이 증가하므로, 반응은 역반응이 우세한 쪽으로 진행되어 폼산이 생성되고, 수소이온농도는 감소한다. 역으로 염기성 용액을 첨가하면 반응은 정반응이 우세한 쪽으로 진행되어 폼산은 이온화되고, 수소 이온의 농도는 증가한다.
KCN 넣는 이유는?
KCN 용액은 수돗물에 들어있는 Fe, Cu Zn 등의 방해 금속의 작용을 방지하기 위해 첨가한다.
완충용액을 넣는 이유?
1) EBT 지시약의 변색을 위해
2) pH의 값에 따라 지시약과 금속 이온의 결합이 결정되므로 pH의 급격한 변화를 막기 위해 (EDTA 적정 시 pH 일정하기 유지)
3) pH 10 이하에서 착물생성은 pH에 영향을 받는다.
++ EBT 지시약은 pH 6.5 이하와 12 이상에서 붉은 계열의 색을 띠고 이 금속착물의 색도 적색을 띠기 때문에 지시약으로 사용할 수 없다. pH 7 ~11 에서는 EBT 지시약의 금속착물 색은 적색을 띠고 EBT 지시약은 푸른색을 띄기 때문에 이 범위에서 사용한다. 이것이 pH 10 완충용액을 가하는 이유이다.
물의 경도 계산식

5. 실험 방법
1) 물(하천수 등) 50ml을 비커에 정확하게 취한다.
2) 여기에 1N KCN 용액 2-3방울, pH 10의 완충 용액 1ml, EBT 지시약 1-2방울을 가한다. KCN 용액은 Fe, Cu, Zn 등 방해 금속의 작용을 방지하기 위하여 첨가하는데 이들이 존재하지 않으면 첨가하지 않아도 된다. 이 용액은 맹독성이므로 취급에 주의를 요한다.
3) 0.01M EDTA 용액을 뷰렛에 넣고 적정한다. 적정하기 전 반응액의 색은 적색이지만 EDTA 용액을 첨가하면 청색이 증가하여 자색이 되고 다음에는 적색이 완전히 없어져 청색으로 된다. 이때가 반응 종말점이며, 이때의 소비량을 읽는다.
6. 실험 기구 및 시약
1N KCN, pH 10의 완충용액, EBT 지시약, 0.01M EDTA 용액, 비커, 뷰렛, 전자저울
7. 참고 문헌

https://en.wikipedia.org/wiki/Ethylenediaminetetraacetic_acid
Ethylenediaminetetraacetic acid - Wikipedia
From Wikipedia, the free encyclopedia "Versene" redirects here. Not to be confused with Versine. Ethylenediaminetetraacetic acid Names IUPAC name N,N′-(Ethane-1,2-diyl)bis[N-(carboxymethyl)glycine][1] Systematic IUPAC name 2,2′,2′′,2′′′-(Etha
en.wikipedia.org
https://www.britannica.com/science/chelate
Chelate | Chelating Agents, Complexes & Compounds
Chelate, any of a class of coordination or complex compounds consisting of a central metal atom attached to a large molecule, called a ligand, in a cyclic or ring structure. An example of a chelate ring occurs in the ethylenediamine-cadmium complex: The et
www.britannica.com
8. 실험 결과
전경도 구하기 (ppm)
전경도 (mg CaCO3/L) = EDTA 소모량 x EDTA 표준농도계수 x 1000/시료(ml) x 1
(EDTA 표준농도수 = 1.05)
우리 조의 EDTA 소비량 = 3.2ml
따라서 H = 3.2 ㅌ 1.05 ㅌ 1000/50 x 1 = 67.2 ppm

제 블로그를 찾아주셔서 감사합니다!
도움이 되셨다면 댓글과 공감 부탁드립니다.✒️
'실험노트 > 일반화학 실험2' 카테고리의 다른 글
| [실험노트] 일반화학2 실험 7. 평형상수와 용해도 곱 (1) | 2022.11.10 |
|---|---|
| [실험노트] 일반화학2 실험 6. 양이온 음이온의 정성분석 실험보고서 (0) | 2022.11.06 |
| [실험노트] 일반화학2 실험 4. OLED 합성 및 제작 실험보고서 (0) | 2022.09.14 |
| [실험노트] 일반화학2 실험 3. 유기염료 합성 실험보고서 (0) | 2022.09.09 |
| [실험노트] 일반화학2 실험 2. 나일론 합성 (0) | 2022.09.06 |




댓글