1. 실험 제목 : 나일론 합성
2. 실험 날짜 :
3. 실험 목적 : 반응성이 큰 산염화물을 이용하여 고분자 중합체인 나일론 끈을 만든다.
4. 실험 이론 :
고분자는 일반적으로 분자량이 1만 이상인 큰 분자를 말한다. 100개 이상의 원자로 구성되어 있고 대개 중합체 (polymer)이다. 작은 분자들이 반복적으로 합쳐져서 고분자를 형성하는 과정을 중합반응 (polymerization)이라고 하고 이때 작은 분자들을 단위체 혹은 단량체 (monomer)이라 한다.
중합 반응에는 첨가중합, 축합중합이 있는데 첨가중합은 단위체들 사이에 결합할 때 단위체가 갖고 있던 다중 결합이 단일 결합으로 변하며 연결되는 반응이다. 단위체가 다중 결합으로 이루어져 있는 경우에 일어나며 폴리에틸렌, PVC 등이 생성되는 반응이 대표적이다. (즉, 단위체가 계속 첨가되어 고분자 화합물을 생성하는 반응)
축합중합이란 단위체가 결합하면서 자신이 갖고 있는 작용기 일부를 잃는 반응이다. 단위체가 단일결합으로 이루어져 있는 경우에 일어나며 펩타이드 결합 반응, 에스테르 결합 반응이 대표적이다.
나일론이란 합성고분자 폴리아마이드의 총칭으로 아마이드 결합 (-CONH-)으로 연결되어 있으며 사슬 모양의 고분자이다. 아마이드 결합은 아미노기와 카르복시기에서 물이 빠져 이루어지는 결합이다. 섬유가 될 수 있는 성질을 지니고 있고 스타킹에 쓰이는 것이 대표적이다.

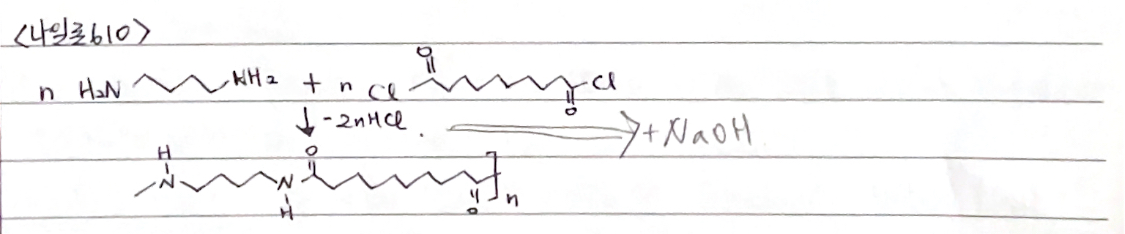
나일론66은 다이카복실산과 다이아민으로부터 만드는데 다이카복실산과 다이아민의 1:1 나일론염을 중합관에 넣고 질소를 통과시켜 산소를 제거한 뒤 1-2시간 동안 215℃ 로 가열한다. 그리고 중합관을 열고 질소 흐름속에서 270℃ 로 가열하는 방법이 있다.
또 다른 방법으로는 반응성이 큰 산염화물을 이용하는 것으로 이 산염화물은 실온에서도 아민과 쉽게 반응하여 폴리아마이드를 만들 수 있다. 염화 세바코일과 헥사메틸렌 다이아민은 실온에서도 반응한다. 나일론 610은 다이카복실산 또는 다이카복실산의 염화물을 다이아민과 연속적으로 반응시켜서 합성할 수 있다. 나일론 610에서 6은 다이아민 화합물에 포함된 탄소의 숫자이고, 10은 다이카복실산 또는 다이카복실산의 염화물에 포함된 탄소의 숫자를 나타낸다.
계면 중합은 서로 섞이지 않는 두 액상에 각각 한 성분씩 시약을 용해하려 두면, 두 액상의 계면 근처에서 두 시약이 접촉하여 중합이 일어난다. 계면에 있는 중합체를 꺼내면 계속해서 중합반응이 일어난다. 이 방법은 두 시약의 비율을 정확히 화학량론적 값으로 계산하지 않아도 짧은 시간에 고분자량의 중합체를 얻을 수 있는 것이 특징이다.
염화세바코일 (sevacoyl chloride)는 옅은 황색의 자극성 냄새가 나는 액체 화합물이다. 화학식은 ClCO(CH2)8COCl. 물에 잘 녹지 않고 유기용매에 잘 녹는다. 나일론 610을 합성할 때 헥사메틸렌다이아민을 녹인 물 층과 염화세바코일을 녹인 유기용매 층을 섞으면 계면에서 나일론 610이 합성된다.
헥사메틸렌다이아민은 분자식 C6H16N2를 가지는 유기화합물이다. 무색, 고체이다.

5. 실험 기구 및 시약 :
사염화탄소 10ml, 100ml 비커, 염화세바코일 0.2ml, 50ml 비커, 증류수, 헥사메틸렌다이아민 0.46g, 수산화소듐 0.08g, 유리 막대, 핀셋, 아세톤
6. 실험 방법 :
1) 사염화탄소 10ml가 들어있는 100ml 비커에 염화세바코일 0.2ml을 용해시킨다.
2) 50ml 비커에 10ml 증류수를 담고 헥사메틸렌다이아민 0.46g과 수산화소듐 0.08g을 용해시킨다.
3) 이 용액을 염화 세바코일 용액이 담긴 비커의 벽을 따라 서서히 부어넣는다. (두 용액이 섞이지 않고 층을 형성할 수 있게 천천히 붓는다.)
4) 나일론 필름이 위 두 용액이 접촉되는 게면에서 생길 것이다. 생성된 나일론 필름을 핀셋으로 조심스럽게 끌어올려 유리 막대에 감는다. 나일론을 끌어올릴 때 중앙에서 뽑히도록 하고 감는 속도를 가능하면 일정하게 유지한다.
5) 유리 막대를 돌려 계면에 생성된 필름을 비커로부터 끌어올리면 계면에서 계속 중합체가 형상되므로 계속 이어지는 나일론 끈을 얻을 수 있다.
6) 중합체가 더이상 생성되지 않을 때까지 유리 막대로 나일론 끈을 감아올린다. (이때 감아올린 나일론 끈은 반응하지 않는 출발물질을 포함하고 있을 수 있으므로 씻기 전까지는 손으로 만지지 않도록 한다.)
7) 생성된 나일론 끈을 아세톤과 물의 1:1 수용액으로 씻은 후 다시 물로 충분히 씻는다. 이때 유리 막대에 감긴 나일론 끈을 빼서 비커에 넣고 안쪽 부분까지 충분히 씻어준다.
8) 이것을 100℃ 이하의 오븐에서 말린 후 녹는점을 측정해보고 문헌 값과 비교해본다.
7. 참고문헌
일반화학실험,자유아카데미
8. 실험 결과
1) 나일론 610에서 610은 어떤 의미가 있는가?

여기서 6, 10의 의미는 탄소수이다.
헥사메틸다이아민은 6개, 세바코일은 10개의 탄소를 가지므로 나일론 610이라 표현한다.
2) 실험 중 수산화소듐을 넣는 이유는 무엇인가?
계면중합반응을 할 때 생성되는 HCl을 중화시키기 위함이다.
제 블로그를 찾아주셔서 감사합니다!
도움이 되셨다면 댓글과 공감 부탁드립니다.✒️
'실험노트 > 일반화학 실험2' 카테고리의 다른 글
| [실험노트] 일반화학2 실험 6. 양이온 음이온의 정성분석 실험보고서 (0) | 2022.11.06 |
|---|---|
| [실험노트] 일반화학2 실험 5. 물의 경도 측정 실험보고서 (0) | 2022.09.28 |
| [실험노트] 일반화학2 실험 4. OLED 합성 및 제작 실험보고서 (0) | 2022.09.14 |
| [실험노트] 일반화학2 실험 3. 유기염료 합성 실험보고서 (0) | 2022.09.09 |
| [실험노트] 일반화학2 실험 1. 임계 마이셀 농도 측정 (1) | 2022.09.03 |




댓글